タンパク質の溶媒和効果:構造平衡 (日本語版)
物理化学的な視点から見たタンパク質の構造安定性の変化について 英語版はこちら
はじめに
川西緑台高校にて私の研究に関する講義を行うにあたって、学生の方が予習できるようなウェブサイトを、日本語で書かれたものと英語で書かれたものの両方を紹介して欲しいとお願いされましたが、私はあまり日本語が分からないので、どの日本語のサイトが皆さんにとって適切かということが分かりませんでした。 また、英語のサイトについても、私の研究内容からかけ離れたもの、レベルが高すぎるもの、化学熱力学やタンパク質化学についての前提知識を要求されるものしかなく、皆さんにとって適切であると思われるサイトはありませんでした。 自然科学の多くの分野は既に確立された概念を元として発展していくものであり、他の分野についての知識も必要とされるものであるため、前提知識を全く用いずに、きちんとした説明を行うことは非常に困難です。 そのような困難があることは重々承知ですが、今回は私の研究テーマである「タンパク質の溶媒和についての熱力学」について、できるだけ分かりやすく説明したいと思います。 Einstein の「ある物事について簡単に説明できないということは、自分自身がその事について十分理解していない」という発言に倣って、ここではタンパク質の構造が物理化学的な効果によってどのように変化するのかを、簡単なモデルと基礎的なタンパク質化学を用いて説明したいと思います。 研究内容について説明を始める前に、川西緑台高校の方々へ私の研究紹介ができるこのような機会をいただき喜ばしく思っていること、ならびに2022年12月14日に皆様にお会いできることを心待ちにしているをここに述べさせていただきます。
タンパク質 〜21種類のアミノ酸からなる高分子〜
タンパク質とは、アミノ酸がお互いに結合することによってできた巨大生体分子のことです。 アミノ酸には、アミノ基とカルボキシ基が含まれており、タンパク質を構成する最も一般的な21種類のアミノ酸について言えば、α炭素に結合している “側鎖” が特徴的です。 側鎖がアミノ酸の性質を決める主な要因であることから、私達は様々な性質に基づいてアミノ酸を分類することができます。 代表的な分類項目の例としては、極性、疎水性、電荷、芳香族/脂肪族性、体積占有率などが挙げられます。 タンパク質を作る際は、ペプチド結合と呼ばれる共有結合によって個々のアミノ酸が結合していきます。 ペプチド結合はアミド基の一種であり、この結合の中には二重結合があることから、ペプチド結合を構成する原子は全て同一平面上に存在しています。
タンパク質の安定化に寄与する相互作用
タンパク質は、ペプチド結合という強い共有結合によって保たれている一方で、タンパク質内に存在するたくさんの弱い相互作用によって、その3次元構造が決定されていきます。 タンパク質には回転に関する自由度が多数あることから、残基間の相互作用は通常、“局所的な” 相互作用と、“非局所的な” 相互作用のいずれかに帰着することができます。 ここで、局所的な相互作用とは、ヘリックスやターンに見られるように、アミノ酸配列上の隣接したアミノ酸残基間に働く相互作用のことを意味しています。 一方、非局所的な相互作用とは、アミノ酸配列上で隣接していないアミノ酸残基間に生じている相互作用のことです。 ここで注意してもらいたいこととしては、これらの用語が、アミノ酸残基が空間的に離れているかどうかではなく、アミノ酸の配列上で離れているかどうかに着目している、ということです。 さて、2つのアミノ酸残基間の相互作用が長距離的か短距離的なものであるかどうかは、主に、それらの間に生じる相互作用の種類に依存しています。 そこで、以下、タンパク質を安定化させるための相互作用について簡単に解説していくことにします。
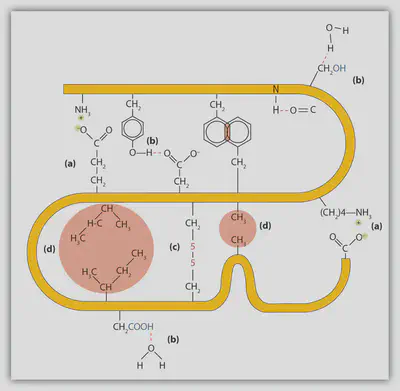
疎水性相互作用 〜油と水の分離〜
疎水効果は、水と油の相分離現象として最もよく認識されていると思いますが、これは従来、極性分子と非極性分子がよく混ざらないことに起因するとされてきました。 これは複雑な現象であり、疎水効果に関する活発な研究は長年行われてきましたが、現在では、水分子−水分子の間の水素結合、そして非極性の溶質の周りに水分子が配向することの結果として現れる効果であることが明らかになっています。 簡単に噛み砕いて言えば、水分子同士の水素結合は非常に強いので、水分子は非極性の溶質を溶かすよりもむしろ他の水分子と相互作用しようとする、ということです。 このことは、異なる溶質分子が重合体(オリゴマー)を形成したり、細長い溶質が自身の上に折りたたまるようにして丸まることによって、非極性の溶質分子は水への露出を最小限にするような位置をとり、水分子は水−水相互作用を最大にできるようにする、ということを意味しています。
タンパク質に関して言えば、疎水効果はタンパク質のフォールディングの最初のステップと考えられています。 具体的には、多くのアミノ酸残基は疎水性(非極性)の側鎖を持っているため、アミノ酸には水分子を排除しようとする傾向があります。 疎水性のアミノ酸残基から水分子を排除するために、タンパク質は通常、疎水性のアミノ酸残基を自分自身に折り畳むようにしてタンパク質の内部に埋め込んでいます。 これをhydrophobic collapseと呼びます。
静電相互作用 〜長距離相互作用〜
個々の原子に関連する電荷を “部分電荷” という言葉で表すのに対し、分子や原子の形式電荷を表すためには一般に “イオン” という言葉を使います。 さて、ここでもタンパク質について取り上げてみます。 具体的には、+1(ヒスチジン、アルギニン、リジン)または -1(アスパラギン酸、グルタミン酸、システイン、セレノシステイン、チロシン)のどちらかの形式電荷を持つイオン性アミノ酸残基について話していきます。 これらのアミノ酸残基の電荷は、古典的な酸塩基化学を用いて議論できます。 つまり、プロトン(水素イオン)の授受により電荷の受け渡しを行なっています。
点電荷間の静電相互作用はクーロンの法則で記述され、2つの点電荷間の静電エネルギーは$1/r$($r$:電荷間距離)で減衰していくとされています。 この長距離力のおかげで、タンパク質は非常に複雑な静電相互作用のネットワークを全体的に形成でき、折りたたまれた状態を安定化させることができます。
水素結合と塩橋 〜イオン性相互作用〜
水素結合とは、いくつかの要因が組み合わさることで形成される非常に強い分子間結合のことです。 具体的には、静電相互作用と軌道の重なり(共有結合性)という2つの寄与を挙げることができます。 アミド基(-N-H)に代表される供与体(Donor)は、カルボニル基(O=C-)などの受容体(Acceptor)と “D-H···:A” のような形で水素を共有することで、水素結合を形成しています。 なお、Dは供与体、Aは孤立電子対を持つ受容体、···は水素Hによって仲介されている供与体−受容体間の相互作用を表しています。
折りたたまれたタンパク質の中には、主に主鎖中のカルボニル基とアミド基の間に、膨大な数の水素結合が存在しています。 これらの水素結合は、タンパク質の二次構造を構成するα-ヘリックスやβ-シート構造における主要な安定化力となっています。
水素結合は静電的な特性を一部持っているため、「水素結合の強さ」は周囲の環境に依存します。 水中の誘電率が約80であるのに対して、タンパク質内部の誘電率は2〜12と推定されており、より “油っぽい” 環境であると言えます。
水素結合の特別な例として、D⁺-H···:A⁻という形で供与体(D)と受容体(A)が帯電している時に形成されるものがあります。 専門用語でこれは “塩橋” と呼ばれています。 荷電した供与体の例としては、リシンの側鎖に含まれるアンモニウムイオンや、アルギニンの側鎖に含まれるグアニジニウムイオンを挙げることができます。 一方、受容体との例としては、アスパラギン酸やグルタミン酸の側鎖に含まれるカルボキシ基が挙げられます。 この相互作用は、電荷による静電的な強さが加わるため水素結合よりもさらに強力なものですが、pH依存性も出てきてしまいます。
ファンデルワールス相互作用
“ファンデルワールス相互作用” はタンパク質の密な充填を可能にし、タンパク質内部の空間充填率は約74%もあります。 これは、同一球の最も効率的な充填と同じ値です。 しかし、実際に内部のタンパク質のダイナミクスは観測されていることからも分かるように、タンパク質は完全に詰まっている訳ではありません。 タンパク質がこのような高い充填率を得ているのは、むしろアミノ酸側鎖の大きさや形が異なることに起因しています。
タンパク質フォールディングの統計学 〜タンパク質はなぜ折り畳まれるのか?〜
これまで述べてきた相互作用に関する議論から、アミノ酸の不均一性が、タンパク質同士の強い相互作用の要因であるということが明らかになったはずです。 このことから、タンパク質の構造を決定する上で、アミノ酸配列(一次構造))が非常に重要であると分かります。 しかし、タンパク質が自分自身と相互作用する方法はたくさんあるのに、なぜタンパク質は特定の立体構造をとる傾向があるのでしょうか? この疑問に答えるために、統計学(事象の発生確率を扱う学問)と熱力学(熱やエネルギーの流れとプロセスの自発性を扱う学問)を組み合わせて使うことにしましょう。 この組み合わせた学問は “統計熱力学” と呼ばれており、私の研究はこの学問に基づいています。 以降、統計熱力学的な観点から、様々な条件下でのタンパク質のフォールディング・アンフォールディング現象について明らかにしていきますが、その前にまず、確率論と熱力学がどのように結びついているかを見ていきましょう。
確率論と熱力学 〜統計熱力学〜
確率計算の最も簡単なもの(数学Aなどで学習したようなもの)は高校生の皆様にとっても身近なものだとは思いますが、統計熱力学においては「微視的状態」や「分配関数」という言葉が登場してしまうため、少し複雑に見えてしまうでしょう。 しかし、サイコロを振ったときに特定の値が出る確率(下図参照)という具体例を使得ことで、これらの単語は簡単に説明することができます。
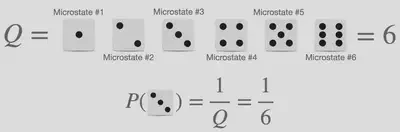
サイコロでいうところの「微視的状態」とは、サイコロを振ったときに出る目のことを指します。 つまり、6面サイコロには6個の微視的状態があり、20面サイコロには20個の微視的状態がある、ということです。 また、「$Q$:分配関数」なる言葉を最も適切に説明するには “tilstandssummen"という、デンマーク語で “状態の総和” を意味する言葉を引き合いに出すのがベストだと考えています。 サイコロで例えると、分配関数とはサイコロが持っている状態の総数に相当するものです。 これら2つの言葉を用いると、サイコロから特定の数字が出る確率は、特定の “微視的状態” を観測する回数(サイコロの目は同様に確からしく出る、つまり重みが0であることから、もちろんこれは1)と、考えられる結果の総数である “分割関数” の比として与えられることは明らかです。 つまり、すべての微視的状態が同じ確率で1/6になる、ということは明らかです。
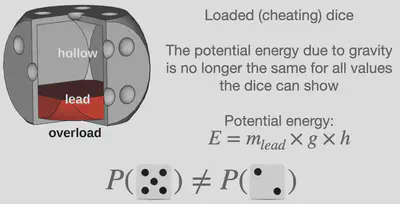
しかし、統計熱力学の創始者であるルートヴィッヒ・ボルツマンは、異なるエネルギーを持つ微視的状態の確率は等しくないことを発見しました。 サイコロの例に例えると、すべての面の質量が等しくなっていないサイコロ(いわゆる “インチキな” サイコロ)を使った場合、重力による位置エネルギーがサイコロの示す色々な数字に対して異なってしまうことがある、ということに相当します。 このような微視的状態の確率を決める式のことをボルツマン分布と呼びます。 高校生の皆様にとって、この式に関する数学的な話はまだ少し複雑かもしれませんが、知っておいていただきたい主なメッセージとしては「微視的状態の確率は、系のエネルギーと温度に依存する」ということです。 この式は、出る目の確率が同様に確からしいサイコロやインチキなサイコロといったものから、原子や分子といったところまで、実に多岐にわたる系に応用されています。
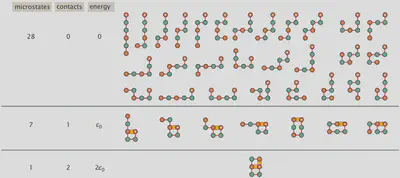
タンパク質の格子モデル 〜HPモデル〜
統計熱力学の基本をある程度理解したところで、次はタンパク質のフォールディングを取り上げるために “HPモデル” を紹介しようと思います。 これは、21種類あるアミノ酸の数を、ファンデルワールス相互作用のような分子間相互作用がある疎水性(Hydrophobic, H)の残基と、隣接する他の残基との分子間相互作用がない極性(polar, P)を持つ残基の2種類だけに減らすようなモデルです。 アミノ酸全体を格子上の球体としてモデル化し、自己回避ランダムウォークを行うことで、タンパク質が取りうるすべての配置を見つけることができます。 例として、“HPPHPH” という配列を用いた場合に取り得る全ての微視的状態を以下に図示します。
この確率の温度 $T$ 依存性を確認するために、H−Hが2つ隣接している折りたたまれた自然な状態になっている確率 $P_{\mathrm{N}}$、H−Hが1つだけ隣接している中間状態となっている確率 $P_{\mathrm{I}}$、H−Hが隣接していない変性状態となっている確率 $P_{\mathrm{D}}$ を、温度の関数として以下に可視化しました。
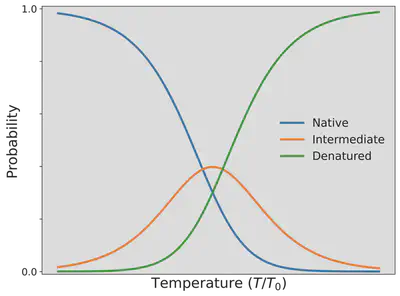
この図から、タンパク質は、温度を上げるにつれて折りたたまれた本来の自然な状態を見つける確率は低くなっていき、代わりに折りたたまれずに変性した状態が優勢になっていくことが分かります。 ラーメンを作る際に卵を茹でたとき、卵白タンパク質であるオボアルブミンやオボトランスフェリンが、透明な水溶性の物質から、水に溶けない白い物質に変わるのはなぜなのか。 これで説明できますね。

まとめ: 細胞環境と純水との違い
ここまで説明してきたように、タンパク質の構造が折り畳まるか、解きほぐれるかどうかというのは温度に依存します。 しかし、これはタンパク質の折り畳み構造を決める多くの要素の氷山の一角に過ぎません。 pH、圧力、分子クラウディング効果、共溶媒効果、他のタンパク質の存在等々、タンパク質の構造を決めるものは他にもたくさんあります。 加えて、タンパク質には生物的な機能のために重要な平衡構造は多くあり、折り畳まれた状態と解きほぐれた状態というのは、それらの平衡構造のほんの一例に過ぎません。
先に述べたような物理化学的な要素が非常に変動しやすい生物学的な環境というのはありふれています。 最もわかりやすい例は細胞内の細胞質かもしれません。 理化学研究所が公開している以下の動画を見れば、細胞内の環境がいかに複雑で混み合っているかが感覚的に分かるかと思います。
この動画内でも述べられていることですが、私は、様々な外的要因があるような時に、タンパク質がどのように振る舞うのかを理解することを目標として研究を行なっています。 これらについての知見を用いれば、様々な環境下で機能を発現するようなタンパク質の設計方法がわかるかもしれません。 また、細胞内のような非常に複雑な環境において働くタンパク質の構造を最適化するすることもできるようになるかもしれません。 私は、スーパーコンピュータを用いて分子シミュレーションをしていくことで、タンパク質化学の基礎的な分野の発展に寄与するだけではなく、人類全体のためになるような治療薬の設計や、工業的に価値のある分子設計に役立つ知見を与えられることを願っています。